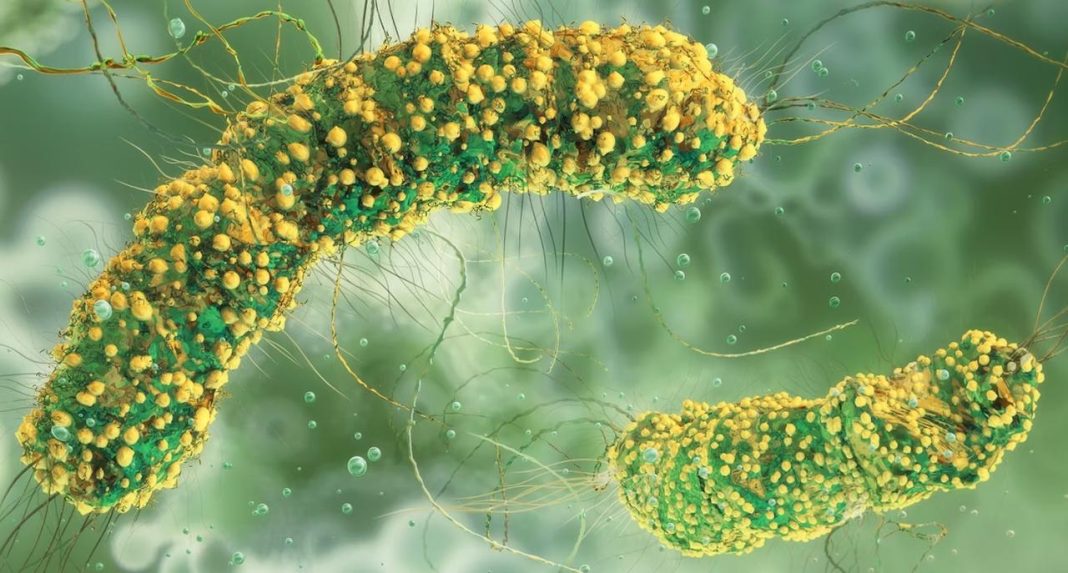
Την τελευταία περίοδο βλέπουμε τα βακτήρια να αναδύονται σαν μια νέα κατηγορία ζωντανών φαρμάκων για τον καρκίνο, με τους επιστήμονες να τα χρησιμοποιούν για να εξοντώσουν τα καρκινική κύτταρα. Μπορεί να είμαστε ακόμα μακριά από μια καθολική θεραπεία για τον καρκίνο, όμως γίνονται συνεχώς πολύ σημαντικά βήματα που σώζουν ζωές.
Τώρα, επιστήμονες ισχυρίζονται πως θα μπορούσαμε να έχουμε βακτήρια που να έχον προγραμματιστεί να εντοπίζουν όγκους και να απελευθερώνουν την θεραπεία σε πολύ στοχευμένα σημεία, ενώ στη συνέχεια θα αυτοκαταστρέφονται χωρίς να αφήνουν ίχνος.
Αυτό ίσως δώσει λύση στο μεγάλο πρόβλημα με καρκινικούς όγκους που είναι δύσκολο να αντιμετωπιστούν, σε δυσπρόσιτα μέρη, αλλά και όγκους που οι θεραπείες δυσκολεύονται να διαπεράσουν. Άλλες φορές, οι όγκοι μπορούν να «αντιδράσουν» καταστέλλοντας ορισμένα μέρη του ανοσοποιητικού συστήματος, μειώνοντας την επίδραση των θεραπειών. Ή οι όγκοι μπορούν να αναπτύξουν αντοχή στις θεραπείες. Από ότι φαίνεται, η χρήση βακτηρίων θα μπορούσε να ξεπεράσει αυτά τα εμπόδια.
Πριν από πάνω από έναν αιώνα, οι γιατροί παρατήρησαν πως ορισμένοι ανθρώπους με καρκίνο, εμφάνισαν βακτηριακές λοιμώξεις που έφτασαν σε ύφεση. Έτσι, τα συμπτώματα ή τα σημάδια του καρκίνου, μειώθηκαν ή εξαφανίστηκαν εντελώς.
Πλέον έχουμε αρχίσει να κατανοούμε γιατί συμβαίνει αυτό. Τα βακτήρια ενεργοποιούν το ανοσοποιητικό σύστημα του σώματος, που στη συνέχεια αρχίζει να επιτίθεται στα καρκινικά κύτταρα.
Μάλιστα, αυτή η προσέγγιση χρησιμοποιείται ήδη κλινικά. Τα βακτήρια αποτελούν τη θεραπεία παγκοσμίως, για ορισμένες περιπτώσεις καρκίνου της ουροδόχου κύστης. Όταν οι γιατροί χορηγούν μια εξασθενημένη εκδοχή του Mycobacterium bovis απευθείας στην ουροδόχο κύστη μέσω καθετήρα, η ανοσολογική απόκριση του οργανισμού καταστρέφει τον καρκίνο.
Αυτό συμβαίνει γιατί ορισμένα βακτήρια έχουν ένα ασυνήθιστοι ταλέντο. Μπορούν να βρεθούν φυσικά και να αναπτυχθούν μέσα σε συμπαγείς όγκους, όπως αυτούς που βρίσκονται μέσα σε όργανα και ιστούς. Αφού κάνουν τη δουλειά τους, αφήνουν τους υγιείς ιστούς σε μεγάλο ποσοστό ανέπαφους.
Το θέμα με τους συμπαγείς όγκους είναι πως διαθέτουν πολλά θρεπτικά συστατικά από νεκρά κύτταρα, κάτι που τους κάνει ιδανικό κατάλυμα για αυτά τα βακτήρια. Μάλιστα, οι όγκοι έχουν χαμηλή περιεκτικότητα σε οξυγόνο και συνήθως έχουν χαμηλότερη ανοσολογική λειτουργία, οπότε δε μπορούν να αμυνθούν έναντι των βακτηρίων.
Όλα αυτά κάνουν τα βακτήρια ιδανικά για τη μεταφορά στοχευμένων αντικαρκινικών θεραπειών, προγραμματίζοντάς να εισέρχονται μέσα στους όγκους.
Τα τελευταία 30 χρόνια περίπου, περισσότερες από 500 ερευνητικές εργασίες, 70 κλινικές δοκιμές και 24 νεοσύστατες εταιρείες έχουν επικεντρωθεί στη βακτηριακή θεραπεία του καρκίνου, με την ανάπτυξη να επιταχύνεται απότομα τα τελευταία πέντε χρόνια.
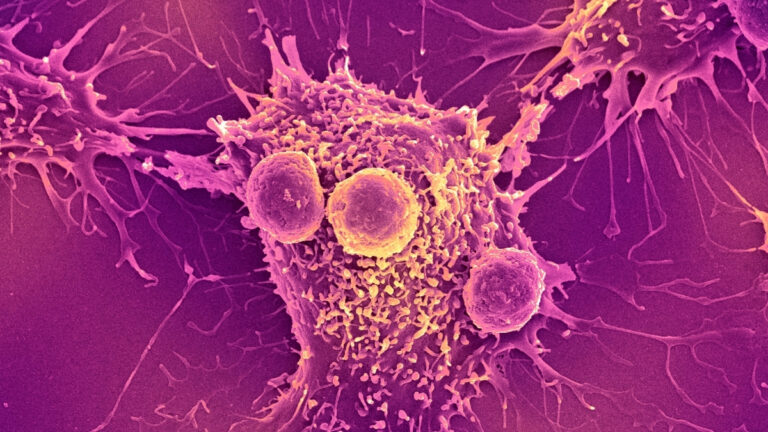
Οι περισσότερες θεραπείες με βακτήρια για τον καρκίνο σε κλινικές δοκιμές σήμερα στοχεύουν σε συμπαγείς όγκους, συμπεριλαμβανομένων των καρκίνων του παγκρέατος, του πνεύμονα, της κεφαλής και του τραχήλου, οι οποίοι είναι οι τύποι που συχνά αντιστέκονται στις συμβατικές θεραπείες.
Από ότι φαίνεται τα βακτήρια μπορούν χρησιμοποιηθούν για την παραγωγή εμβολίων κατά του καρκίνου. Τα εμβόλια κατά του καρκίνου λειτουργούν παρουσιάζοντας στο ανοσοποιητικό σύστημα τα μοναδικά μοριακά «δακτυλικά αποτυπώματα» ενός καρκίνου, γνωστά ως αντιγόνα όγκων, ώστε να μπορεί να εντοπίσει και να εξαλείψει τα καρκινικά κύτταρα που εμφανίζουν αυτά τα αντιγόνα.
Τα ίδια τα βακτήρια μπορούν να χρησιμοποιηθούν σαν μεταφορείς αυτών των αντικαρκινικών εμβολίων. Χρησιμοποιώντας τη γενετική μηχανική, οι γενετικές οδηγίες (ή το DNA) στα βακτήρια που θα μπορούσαν να μας κάνουν να νοσήσουμε μπορούν να αφαιρεθούν και να αντικατασταθούν με DNA για ανοσοδιεγερτικά αντιγόνα όγκων.
Η Listeria monocytogenes είναι ο πρωταγωνιστής σε περισσότερες από 30 κλινικές δοκιμές εμβολίων κατά του καρκίνου. Δυστυχώς, οι περισσότερες από αυτές τις δοκιμές δεν έδειξαν ότι αυτές οι θεραπείες λειτουργούν καλύτερα από τις τρέχουσες. Η πρόκληση είναι να καταφέρουμε να διδάξουμε στο ανοσοποιητικό σύστημα, να αναγνωρίζει τον καρκίνο και να του επιτίθεται, όμως όχι σε υπερβολικό βαθμό ώστε να προκαλεί ισχυρή και επικίνδυνη υπερδιέγερση.
Σε μεγάλο βαθμό, οι τρέχουσες κλινικές δοκιμές με βακτήρια, συνδυάζονται με ανοσοθεραπείες και χημειοθεραπείες, μέσω εξατομικευμένων θεραπευτικών σχεδίων για την ενίσχυση της επίθεσης του οργανισμού στον καρκίνο.
Διάφορες προσεγγίσεις έχουν ολοκληρώσει κλινικές δοκιμές φάσης 2. Αυτές περιλαμβάνουν τη χρήση ανοσοθεραπείας σε συνδυασμό με τροποποιημένη Listeria για την ενεργοποίηση του ανοσοποιητικού συστήματος για υποτροπιάζοντα καρκίνο του τραχήλου της μήτρας. Άλλες δοκιμές έχουν χρησιμοποιήσει τροποποιημένη σαλμονέλα, σε άτομα με προχωρημένο καρκίνο του παγκρέατος, παράλληλα με χημειοθεραπεία, ώστε να αυξηθούν οι πιθανότητες επιβίωσης.
Το να μπορούμε να μεταφέρουμε ένα φάρμακο μέσω των βακτηρίων, θα μας επέτρεπε να καταστρέψουμε έναν όγκο από το εσωτερικό του, σαν καμικάζι αυτοκτονίας. Για αυτό χρειαζόμαστε έναν πολύ ακριβή γενετικό έλεγχο, για τον τρόπο που συμπεριφέρονται αυτά τα βακτήρια. Οι ερευνητές έχουν ήδη βρει τρόπους να προγραμματίσουν τα βακτήρια, ώστε να ανιχνεύουν και να ανταποκρίνονται σε μοριακά σήματα, γύρω από έναν όγκο.
Στη συνέχεια, αυτά τα βακτήρια μπορούν να προγραμματιστούν ώστε να αυτοκαταστρέφονται, αμέσως μετά τη χορήγηση ενός φαρμάκου, να εκκρίνουν μόρια που ενισχύουν το ανοσοποιητικό και να ενεργοποιούν άλλες θεραπείες.
Οι ερευνητές κατασκευάζουν «πολυλειτουργικά» στελέχη που συνδυάζουν πολλές στρατηγικές θεραπείας ταυτόχρονα.
Προβιοτικά είδη που χρησιμοποιούνται στον άνθρωπο εδώ και πολλά χρόνια είναι επίσης υποψήφια, συμπεριλαμβανομένων των Escherichia coli Nissle, Lactobacillus και Bifidobacterium . Αυτά μπορούν να τροποποιηθούν για να παράγουν μόρια που σκοτώνουν τον καρκίνο ή να τροποποιήσουν το περιβάλλον γύρω από τον όγκο.
Εδώ όμως έχουμε μέχρι στιγμής ένα πρόβλημα. Αν και αυτή η τεχνική έχει αποδειχθεί αρκετά ασφαλής, η εύρεση της σωστής δόσης που διαφέρει από άτομο σε άτομο, παραμένει μια δύσκολη διαδικασία, ώστε να μπορέσουν να διατηρηθεί μια ισορροπία.
Παράλληλα, με τα βακτήρια να είναι ζωντανοί οργανισμοί, η εξέλιξή τους είναι απρόβλεπτη, δημιουργώντας έτσι άλλα προβλήματα. Ακόμα και τα παραμετροποιημένα στελέχη, είναι δυνατό να προκαλέσουν λοιμώξεις ή να δημιουργήσουν μεγάλες φλεγμονές.
Έτσι, οι επιστήμονες αναπτύσσουν στρατηγικές «βιοπεριορισμού» – μηχανικές δικλείδες ασφαλείας που εμποδίζουν την εξάπλωση των βακτηρίων πέρα από τους όγκους ή τα ωθούν να αυτοκαταστραφούν μετά τη θεραπεία.
Αν καταφέρουν οι ερευνητές να ξεπεράσουν αυτά τα προβλήματα, θα έχουμε μια μεγάλη αλλαγή στον τρόπο που αντιμετωπίζουμε τον καρκίνο με φάρμακα σε βακτήρια που δε θα έχουν τις παρενέργειες που αντιμετωπίζουν οι καρκινοπαθείς από χημειοθεραπείες ή ανοσοθεραπείες. Αυτό είναι και το ζητούμενο και είναι ίσως το μέλλον για την αντιμετώπιση του καρκίνου!
Ακολουθήστε το Techmaniacs.gr στο Google News για να διαβάζετε πρώτοι όλα τα τεχνολογικά νέα. Ένας ακόμα τρόπος να μαθαίνετε τα πάντα πρώτοι είναι να προσθέσετε το Techmaniacs.gr στον RSS feeder σας χρησιμοποιώντας τον σύνδεσμο: https://techmaniacs.gr/feed/.